



Por Marina Farrel
Desde nosso nascimento e ao longo de nossa vida, vários micro-organismos sobrevivem e se multiplicam nas superfícies de tecidos de nosso corpo, como a pele e mucosas. Este processo é conhecido como colonização e uma das principias superfícies colonizadas são as que fazem parte do nosso sistema de digestão. Micro-organismos encontrados, na parede intestinal podem propiciar tanto benefícios quanto malefícios para nossa saúde. Podem interferir no processo de digestão, sintetizar micronutrientes e atuando em nosso sistema imune. Esta ação pode ser positiva, nos protegendo de certas doenças ou negativa quando são os agentes diretos ou indiretos de doenças.
Entender como se dá esse delicado equilíbrio entre os efeitos benéficos e os maléficos da microbiota anfibiôntica é motivo de intenso estudo de diversos cientistas. O conjunto de bactérias que colonizam nossas superfícies é denominado microbiota anfibiôntica. Essa microbiota pode sofrer modificações dependendo do tipo de alimentos consumidos por uma pessoa. Deste modo, é muito importante manter uma dieta saudável para que sua microbiota seja composta por micro-organismos simbiontes, ou seja, que vivem em harmonia e causam benefícios e não doenças. Estima-se que a microbiota intestinal humana seja composta de 103 a 104 micro-organismos, o que supera a quantidade de células humanas.
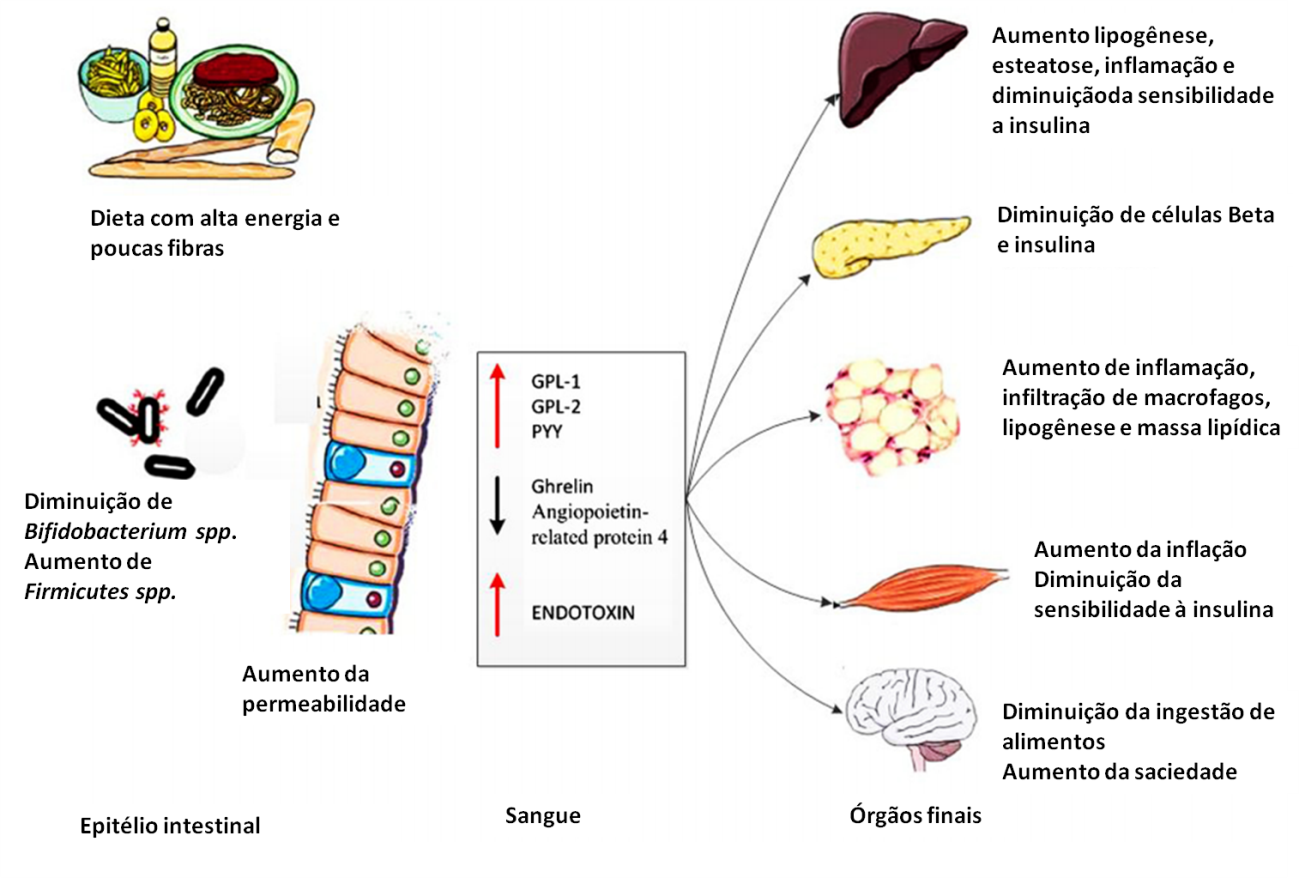
A obesidade resulta de alterações no equilíbrio de energia, isto é, como o corpo regula o consumo de energia, gasto e o armazenamento. Já que a fome representa um perigo maior para o organismo do que o excesso de alimentos, nossos sistemas biológicos são mais voltados para nos proteger contra perda de peso do que o ganho de peso, ou seja, um modelo econômico. Os restaurantes estão cada vez mais oferecendo alimentos baratos, saborosos e altamente calóricos. Evidências recentes sugerem que a microbiota intestinal afeta a aquisição de nutrientes e regulação de energia, e que grupos de pessoas obesas e magras podem apresentar diferenças no tipo de micro-organismos que fazem parte da microbiota intestinal.
Um experimento realizado por um cientista Frances chamado Millian e por seus colaboradores mostrou que a obesidade está associada às mudanças observadas na quantidade relativa das duas divisões bacterianas dominantes no intestino, Bacteroides e Firmicutes. Naquele estudo, a proporção relativa de Bacteróides estava diminuída em pessoas obesas em comparação com pessoas magras enquanto que a proporção de Firmicutes estava aumentada em pessoas obesas. Foi observado que a microbiota mais comum no obeso possuía maior capacidade para absorver energia da dieta. Além disso, quando os pesquisadores introduziram no intestino de camundongos uma microbiota obtida de um indivíduo obeso foi observado um aumento da gordura corporal total dos animais, sem qualquer aumento no consumo de alimentos.
Foi então observado que, com uma dieta não balanceada, as bactérias que produzem enzimas capazes de quebrar polissacarídeos não digeríveis normalmente pelo corpo humano foram selecionadas, introduzindo calorias adicionais na dieta e diminuindo as calorias eliminadas nas fezes. Estudos com camundongos colonizados com uma microbiota de obeso apresentaram não somente um aumento da gordura corporal total, mas também passavam a apresentar resistência à insulina. Este aumento de peso e resistência à insulina parece ocorrer por causa da extração mais eficiente de energia pela microbiota a partir de fibras não digeríveis, o que gera no hospedeiro um aumento da absorção instestinal de glicose, aumento da glicose (glicemia) e da insulina (insulinemia) no sangue. Assim, tudo indica que a microbiota intestinal participa da digestão de polissacarídeos, aumentando a quantidade de glicose no fígado e portanto, o seu armazenamento em forma de gordura (lipogênese).
Foi sugerido que a dieta rica em gordura (comum em indivíduos obesos) levaria ao desequilíbrio da microbiota e, uma microbiota em desequilíbrio, poderia contribuir para a obesidade. Assim, uma conduta que vem sendo proposta para o tratamento e prevenção da obesidade é garantir uma microbiota equilibrada e um funcionamento intestinal adequado. Um método sugerido para recompor uma microbiota equilibrada foi o uso de probióticos. A Organização Mundial de Saúde define probióticos como “organismos vivos que, quando administrados em quantidades adequadas, conferem benefício à saúde do hospedeiro”. Como função benéfica no organismo, alguns estudos têm sugerido que os probióticos teriam efeito sobre o equilíbrio bacteriano intestinal: controle do colesterol e de diarreia. Certos suplementos probióticos podem ser componentes de alimentos industrializados presentes no mercado, como leites fermentados, iogurte, ou podem ser encontrados na forma de pó ou cápsulas. Finalmente, é preciso deixar claro que nem sempre probióticos geram benefícios para nossa saúde. Por exemplo, pesquisas recentes demonstraram que tratamentos baseados em probióticos estavam associados ao aumento de mortes em pacientes com pancreatite aguda. Assim, apesar de alguns resultados serem animadores, existe a necessidade de mais investigações sobre o efeito das adições rotineiras de probióticos em alimentos ou de seu uso como suplementos.
Referências:
Cani, P. D., Possemiers, S., Van de Wiele,T., Guiot, Y., Everard, A., Rottier,O., Geurts, L., Naslain, D., Neyrinck,A., Lambert, D. M., Muccioli, G.G., and Delzenne, N. M. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2-driven improvement of gut permeability. Gut 58, 1091–1103, 2009.
Vyas, U. & Ranganathan, N. Probiotics, prebiotics, and synbiotics: gut and beyond. Gastroenterol Res Pract., 2012.
Angelakis E, Armougom F, Million M, Raoult D.The relationship between gut microbiota and weight gain in humans. Future Microbiol. 7(1):91-109., 2012.
Marik, P.E. Colonic flora, Probiotics, Obesity and Diabetes. Front Endocrinol (Lausanne). 3:87., 2012.
 Por Thais Gonçalves Ferreira
Por Thais Gonçalves Ferreira
Helicobacter pylori invadindo as células epiteliais do estômagoInfecção é um processo de colonização de um organismo hospedeiro por uma espécie estranha, onde a espécie infectante procura utilizar os recursos deste hospedeiro para se multiplicar, levando a evidentes prejuízos para ele. Assim, o organismo patogênico acaba por interferir na fisiologia normal do hospedeiro, podendo acarretar diversas consequências, dentre elas doenças graves, como o câncer.
Atualmente, há evidências de que alguns tipos de vírus, bactérias e parasitos associados a infecções crônicas estão presentes no processo de desenvolvimento do câncer. Segundo o Manual de Infecção e Câncer, desenvolvido pelo INCA, no mundo, estima-se que 18% dos casos de câncer se devam a agentes infecciosos. Desse modo, pesquisas têm revelado que alguns micro-organismos podem estar desempenhando um importante papel como agentes cancerígenos.
Um estudo recente publicado pela “International Agency for Research on Cancer (IARC)”, revelou que de 12,7 milhões de novos casos da doença registrados em 2008, pelo menos 2 milhões estão relacionados à infecções. É importante salientar que a evolução da doença depende do tempo que o micro-organismo já coloniza o hospedeiro, bem como da propensão deste hospedeiro ao desenvolvimento do câncer.
Ainda, de acordo com a Organização Mundial da Saúde (OMS), considerando-se a magnitude da ocorrência de câncer associada a processos infecciosos, 26% dos casos de câncer seriam evitáveis nos países em desenvolvimento com a adoção de ações de prevenção de infecções sabidamente relacionadas à essa doença.
A tabela abaixo apresenta alguns dos principais agentes em que a evidência de potencial carcinogênico é considerada adequada pela IARC, a unidade da OMS para pesquisa em câncer.
Fica evidente que as medidas preventivas podem reduzir de forma efetiva a incidência de câncer relacionada a estes agentes.
|
Agente |
O que causa? |
Tipo de câncer |
A prevenção é possível? |
|
Papilomavírus humano |
Vírus que causam lesões nos órgãos genitais |
Carcinoma cervical |
Sim, através da vacinação e uso de preservativo |
|
Helicobacter pylori |
Bactéria associada a gastrite e úlceras |
Carcinoma gástrico Linfoma gástrico |
Sim, através de antiobióticos que tratem a infecção |
|
Vírus da hepatite B e C |
Alojam-se no fígado, danificando suas células |
Hepatocarcinoma |
Existe vacina para hepatite B apenas |
|
Vírus Epstein-Barr |
Inchaços nos gânglios, febre e comprometimento do fígado e do baço |
Linfoma de Burkitt, Hodgkin e Carcinoma de nasofaringe |
Não, apenas monitoramento e tratar o paciente |
|
Schistosoma haematobium |
Parasita que causa dores no ventre e complicações na bexiga |
Carcinoma de bexiga |
Sim, através do saneamento básico e água tratada. |
Referências Bibliográficas:
Demers, A.A.; Shearer, B.; Severini, A.; Lotocki, R.; Kliewer, E.V.; Stopera, S.; Wong, T.; Jayaraman, G. Distribution of human papillomavirus types, cervical cancer screening history, and risk factors for infection inManitoba. Chronic. Dis. Inj. Cab., 32 (4): 177-185, 2012.
Hur, H.; Lee, S.R.; Xuan, Y.; Kim, Y.B.; Lim, Y.A.; Cho, Y.K.; Han, S.U. The effects of Helicobacter pylori on the prognosis of patients with curatively resected gastric cancers in a population with high infection rate. J. Korean Surg. Soc., 83 (4): 203-211, 2012.
Oh, J.K.; Shin, H.R.; Lim, M.K.; Cho, H.; Kim, D.I.; Jee, Y.; Yun, H.; Yoo, K.Y. Multiplicative synergistic risk of hepatocellular carcinoma development among hepatitis B and C co-infected subjects in HBV endemic area: a community based cohort study. BMC Cancer, 12 (1): 452, 2012.
Fang, C.Y.; Huang, S.Y.; Wu, C.C.; Hsu, H.Y.; Chou, S.P.; Tsai, C.H.; Chang, Y.; Takada, K.; Chen, J.Y. The synergistic effect of chemical carcinogens enhances Epstein-Barr virus reactivation and tumor progression of nasopharyngeal carcinoma cells. PLoS One, 7 (9): e44810, 2012.
Botelho, M.C.; Machado, J.C.; Brindley, P.J.; Correia, d.a.;Costa, J.M. Targeting molecular signaling pathways of Schistosoma haemotobium infection in bladder cancer. Virulence, 2 (4): 267-279, 2011.
http://www1.inca.gov.br/situacao/arquivos/causalidade_infeccao_cancer.pdf
http://saude.abril.com.br/edicoes/0353/medicina/microbios-cancer-698019.shtml
 Por Deborah Leite
Por Deborah Leite
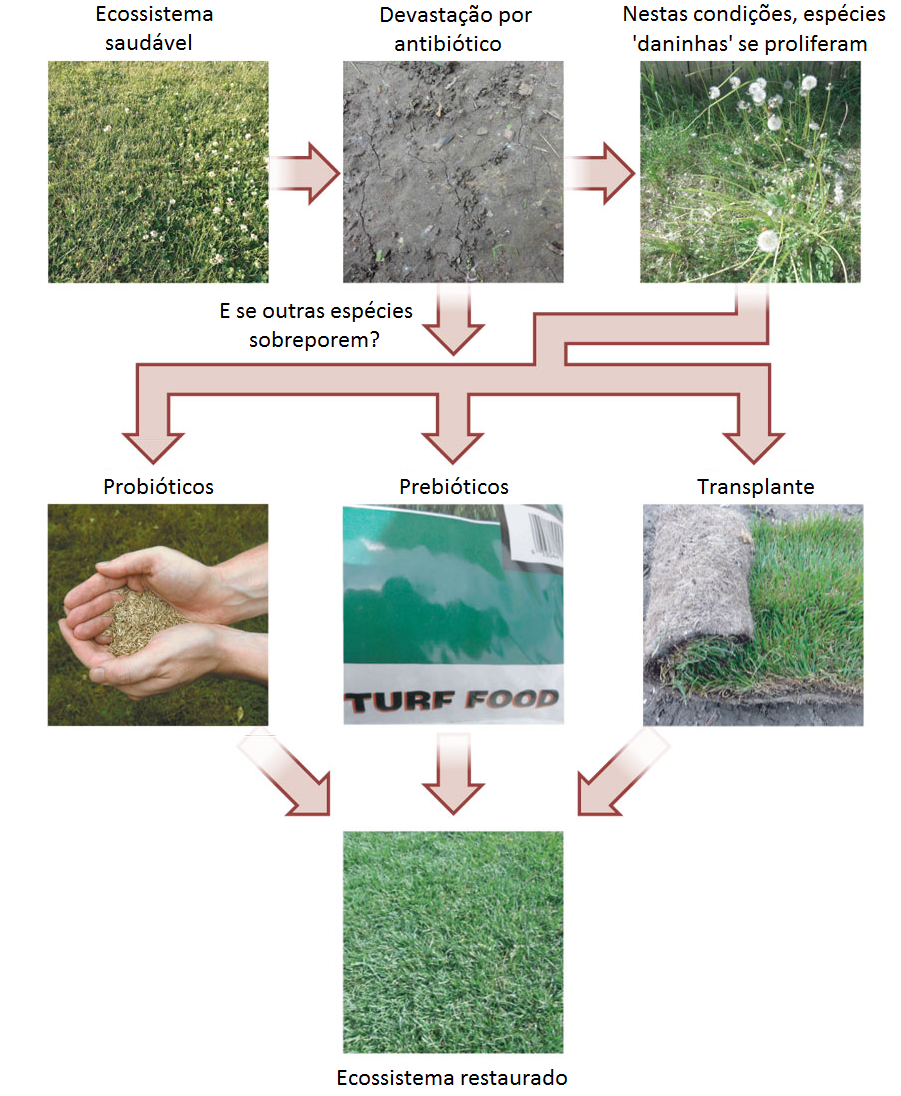
A microbiota intestinal humana exerce um papel importante tanto na saúde quanto na doença. E em alguns aspectos, a manutenção de uma microbiota saudável se assemelha a cuidar de um jardim (Figura 1). Por vezes, intervenções graves podem levar à degradação total deste ecossistema, como por exemplo, através de doenças e/ou pelo uso de antibióticos. Embora seja possível a recuperação espontânea, não é garantido que ela ocorra em todos os casos. Devido a isto, várias estratégias podem ser utilizadas para restaurar este ecossistema: probióticos, prebióticos ou até mesmo transplantar o ecossistema microbiano inteiro, por exemplo, a partir de uma amostra de fezes e um processo denominado transplante fecal.
Estas estratégias podem estar associadas a suplementação da dieta com carboidratos não-digeríveis (prebióticos) que são benéficos, porque estimulam seletivamente o crescimento e a atividade de uma ou mais espécies bacterianas no cólon. Outra forma de recuperação ou fortalecimento deste ecossistema intestinal seria através da ingestão de micro-organismos vivos, administrados em quantidades adequadas e que conferem benefícios à saúde do hospedeiro (probióticos). Os probióticos em sua maioira pertencem aos gêneros Lactobacillus, Bifidobacterium e Bacillus. Entretanto em alguns caso graves de diarréia crônica é necessário lançar mão de uma medida capaz de restaurar a complexa microbiota intestinal por completo e neste caso transplante fecal é uma opção terapêutica.
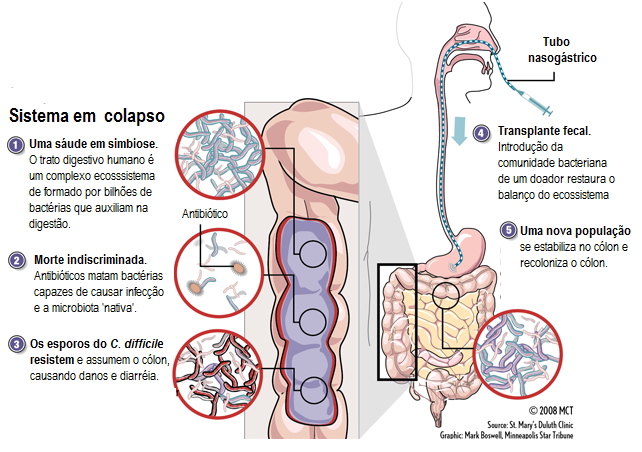
A maioria das pessoas já ouviu falar sobre probióticos e prebióticos, mas poucos conhecem algo sobre transplante fecal. Apesar de poucas pessoas conhecerem esta técnica, o transplante fecal não é uma prática nova. O primeiro caso foi descrito por Eiseman e colaboradores em 1958, e a descrição do segundo ocorreu em 1981 por Bowden. Hoje este tipo de terapia é utilizada por vários especialistas com sucesso, sem quaisquer efeitos adversos. Desde então, existem muitos relatos de transplantes de fezes através de colonoscopia ou sonda nasogástrica, e a maioria destes procedimentos estavam relacionados a utilização desta técnica no tratamento da infecção por Clostridium difficile, para o restabelecimento da microbiota após a infecção. Um dos principios do método do transplante fecal é que nem todos os micro-organismos da microbiota podem ser isolados e cultivados em laboratório.
Recentemente, 19 pacientes infectados por C. difficile foram submetidos a um transplante de fezes (Figura 2) e permaneceram livres da doença por até quatro anos. Este resultado sugere que esta terapia pode ser benéfica para o tratamento desta doença, e segundo outros trabalhos é eficaz no tratamento de outros tipos de gastroenterites. Já existem estudos que relatam que o uso progressivo de antibióticos contra C. difficile e outros micro-organismos também é capaz de afetar negativamente a microbiota e sugerem que a recolonização do trato intestinal por uma nova microbiota pode ser empregada através do transplante.
Em outro estudo sobre o tema, foram utilizadas técnicas moleculares a fim de reconhecer os grupos microbianos bioindicadores de uma microbiota ‘saudável’ ou ‘doente’. Este estudo descreve o efeito de uma bacterioterapia através de um transplante fecal em pacientes com diarréia a fim de restabelecer a microbiota do cólon. Neste estudo, Firmicutes e Bacteriodetes não foram encontrados nos indivíduos doentes e dias após o transplante já foi possível ver reestabelecimento da microbiota e a recuperação do quadro clínico.
Vale a pena lembrar que o entendimento sobre o efeito da aplicação desta técnica parte de princípios ecológicos como interações entre hospedeiro e micro-organismos. Portanto, estudos sobre a composição, a diversidade e a função de comunidades microbianas intestinais são importantes para elaborar estratégias para tratamentos futuros.
O Transplante fecal, embora pareça ser uma abordagem estranha para os leigos, pode ser uma boa opção de tratamento e tem a capacidade de restabelecer a microbiota intestinal saudável. Por mais desagradável que possa parecer.
Referências:
Eisman, B.; Silen, W; Bascom, G.S.; Kauvar, A.J. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery. 1958;44(5):854-859.
Bowden, T.A.; Mansberger, A.R.; Lykins, L.E. Pseudomembranous enterocolitis: mechanism of restoring floral homeostasis. Am Surg. 1981;47:178-183.
Yoon, S.; Brandt, L.J. Treatment of refractory/recurrent C. difficile-associated disease (CDAD) by donated stool transplanted via colonoscopy: a case series of twelve patients. Journal of Clinical Gastroenterology. 2010;44:562-566
Grehan, M.J.; Borody, T.J.; Leis, S.M.; Campbell, J.; Mitchell, H.; Wettstein, A. Durable alteration of the colonic microbiota by the administration of donor fecal flora. Journal of Clinical Gastroenterology. 2010; 44(8):551-561.
Floch, M. H. Fecal Bacteriotherapy, Fecal Transplant, and the Microbiome. Journal of Clinical Gastroenterology. 2010; 44(8): 529-530
Khoruts, A.; Dicksved, J.; Jansson, J.K.; Sadowsky, M. J. 2010. Changes in the composition of the human fecal microbiome following bacteriotherapy for recurrent Clostridium difficile-associated diarrhea. Journal of Clinical Gastroenterology. 2010, 44:354-360.
Lozupone, C.A.; Stombaugh, J.; Jansson, J.K.; Gordon, J.I.; Knight, R. Factors that shape composition and resilience of human intestinal microbiota. Nature. 2012. (in press)
