




A bactéria Capnocytophaga canimorsus é comum em saliva de cães, gatos e já foi encontrada até em humanos. Ela é responsável por casos de sepse (infecção com repercussões generalizadas) em pacientes. Apesar de raros, 30% dos casos de sepse por C. canimorsus são fatais. A infecção pode ocorrer após pequenas mordidas, arranhões ou até lambidas.
Prevalente em cães (cerca de 74% são positivos) e gatos (cerca de 57%), até o momento, mais de 480 casos de infecções por C. canimorsus em humanos foram descritos. O grande número de casos associados à saliva canina pode estar relacionado ao hábito recorrente que os cães têm de lamberem seus donos.
Conhecida por causar infecções localizadas, a C. canimorsus é como endocardite e meningite, e está associada com bacteremia (infecção documentada na corrente sanguínea) e sepse (infecção, que pode ser ou não documentada na corrente sanguínea, acompanhada de manifestações generalizadas e distúrbios circulatórios). As pessoas em maior risco de desenvolver essas infecções são pacientes asplênicos (sem baço), pessoas que fazem uso abusivo de bebidas alcoólicas, os fumantes inveterados e pessoas com o sistema imune comprometido.
Embora os pacientes infectados apresentem um histórico de imunossupressão, constata-se que um número significativo não tem um fator de risco óbvio. Assim, C. canimorsus não pode ser considerado um patógeno exclusivamente oportunista.
A infecção por C. canimorsus apresenta uma gama de sinais e sintomas. Em alguns pacientes observa-se inicialmente, apenas uma reação no local da mordida, sem sinais de infecção, mas que apresenta um quadro evolutivo ao longo de alguns dias, identificado por sintomas como fadiga, dor abdominal, e falta de ar. Outros, principalmente os pacientes imunodeficientes, podem apresentar um curso rápido e grave da infecção. Nestes casos, pode-se diagnosticar a presença de sepse, meningite, osteomielite, peritonite, endocardite, pneumonia ou artrite séptica, além de necrose de membros. A causa mais comum de morte entre os pacientes com infecção por C. canimorsus é um choque séptico. Os pacientes com mais de 50 anos são mais vulneráveis ao desenvolvimento de choque séptico.
A exposição humana à flora oral de um cão pode ocorrer através de uma mordida ou arranhão ou até mesmo pelo convívio frequente e próximo com o animal, representando uma ameaça à saúde do dono. Na maioria dos casos, a infecção ocorre após uma mordida de cachorro.
O isolamento e a identificação das bactérias a partir do material biológico não é fácil e muitas vezes demorado, devido ao lento crescimento das bactérias em meios microbiológicos, por ser um organismo exigente e de crescimento lento, sua cultura e isolamento são difíceis.
A amoxicilina com ácido clavulânico é considerada a droga de escolha usada na profilaxia das infecções por C. canimorsus. Mesmo com a administração de terapia antimicrobiana adequada, a bacteremia induzida por C. canimorsus pode evoluir para uma doença debilitante ou choque séptico.
Em particular, C. canimorsus são resistentes à morte por mecanismos observados comumente para outras bactérias. A melhor forma de tratar esse tipo de doença é por meio do uso de antibióticos, juntamente com acompanhamento médico.
Quanto antes se procurar ajuda profissional, maiores são as chances de recuperação. Uma forma de prevenção dessa doença é o cuidado com o seu animal de estimação. Mantenha-o sempre limpo, cuidando bem da higiene do animal, da alimentação e, principalmente, evite contatos diretos a sua com boca/saliva.
ZAJKOWSKA J., e col. “Capnocytophagacanimorsus – an underestimated danger after dog or cat bite – review of literature”. PRZEGL EPIDEMIOL;70(2): 289-295.2016.
TANI N., e col. “An Immunocompetent Case of Capnocytophaga canimorsus Infection Complicated by Secondary Thrombotic Microangiopathy and Disseminated Intravascular Coagulation”. Intern Med 58: 3479-3482, 2019.
HESS E., e col. “Capnocytophaga canimorsus Capsular Serovar and Disease Severity, Helsinki Hospital District, Finland, 2000–2017”. Emerging Infectious Diseases; 24:12. 2018.
FEIGE, K , Pia Hartmann, J. T. Lutz. “Fulminante Sepsis nach Capnocytophaga-canimorsus-Infektion”. Anaesthesist; 67:34–37. 2018.
HOPKINS A., e col. “Capnocytophaga bacteremia precipitating severe thrombocytopenia and preterm labor in an asplenic host”. Infectious Disease Reports; 11:8272.2019.
MALLY M., e col. “Prevalence of Capnocytophaga canimorsus in dogs and occurrence of potential virulence factors”. Microbes and Infection; 11: 509-514. 2009.
RENZI F, Manfredi P, Dol M, Fu J, Vincent S, Cornelis GR. Glycan-foraging systems reveal the adaptation of Capnocytophaga canimorsus to the dog mouth. mBio6(2):e02507-14. 2015.
 Por Daniela Masid de Brito, Rebeca de Souza Brum, Bruno Marques Vieira, Manuella Lima, Elizabeth Chen Dahab, Kassiane Melo de Oliveira, Renato Nunes Ferreira. Matéria escrita na disciplina de extensão de integração acadêmica do Curso de Bacharelado em Ciências Biológicas: Projeto de extensão: SAÚDE É NOTÍCIA - OFICINA DE REDAÇÃO CIENTÍFICA Divulgação - Crítica - Síntese. Creditação da extensão no Instituto de Microbiologia.
Por Daniela Masid de Brito, Rebeca de Souza Brum, Bruno Marques Vieira, Manuella Lima, Elizabeth Chen Dahab, Kassiane Melo de Oliveira, Renato Nunes Ferreira. Matéria escrita na disciplina de extensão de integração acadêmica do Curso de Bacharelado em Ciências Biológicas: Projeto de extensão: SAÚDE É NOTÍCIA - OFICINA DE REDAÇÃO CIENTÍFICA Divulgação - Crítica - Síntese. Creditação da extensão no Instituto de Microbiologia.Em 16 de setembro de 2019 o Centro Estadual de Pesquisa de Virologia e Biotecnologia mais conhecido como Instituto Vector localizado em Koltsovo, na Sibéria, sofreu um incêndio.
O acidente ocorreu durante uma inspeção sanitária e a causa teria sido a explosão de um cilindro de gás seguida de incêndio. A explosão não causou danos estruturais ao prédio, contudo deixou um funcionário com queimaduras de terceiro grau.
O Instituto Vector, um dos principais centros de pesquisa do mundo, é responsável pelo desenvolvimento de vacinas e de ferramentas para o diagnóstico e tratamento de doenças infecciosas. Seu repositório contém diversas amostras biológicas de patógenos como os vírus da Ebola, gripe aviária e varíola e, funcionou durante a Guerra Fria como centro de desenvolvimento de armas biológicas. Com o final da Guerra, o Instituto passou a trabalhar com pesquisa e desenvolvimento. Além do Vector, o Centro de Controle de Doenças dos Estados Unidos, também possui amostras biológicas do Vírus da Varíola.
Para tranquilizar o público, as autoridades locais e os responsáveis pelo Instituto relataram que nenhuma amostra contendo material biológico foi atingida, por não estarem na sala onde ocorreu a explosão.
No entanto, o acidente alertou os pesquisadores e os profissionais de saúde para o que poderia ocorrer, caso tivesse sido atingido o local de armazenamento do vírus. A grande questão que o episódio suscita é se este tipo de acidente é capaz de iniciar uma epidemia, ou mesmo uma pandemia. Os dados do problema são discutidos abaixo, para o caso específico da varíola, uma doença temível, com a qual a maior parte da população mundial nunca teve contato, e sobre a qual não se tem informações elementares.
A varíola é uma doença letal, altamente contagiosa, encontrada exclusivamente em seres humanos, e causada pelo vírus Orthoposxivirus varíolae. Há registros quantitativos de mortes desde o século XVII até a década de 1980, mas a prática da imunização contra a varíola antecede esse período, nos países do Extremo-Oriente, como a China, indicando a importância dessa infecção para a saúde das populações em sociedades pré-industriais.
Tabela: Informações:

Segundo a Organização Mundial da Saúde, o último registro de paciente com varíola ocorreu em 1977. Devido a intensas campanhas de vacinação, sendo esta extremamente eficaz (apenas uma dose garante imunidade duradoura), com tempo médio de imunização de 10 anos. A erradicação da varíola foi possível porque não há reservatório animal da doença, nem carreadores humanos (sadios ou cronicamente infectados). Assim, quando o último paciente não tem mais a quem passar a infecção porque a comunidade está vacinada, a transmissão se extingue por falta de hospedeiros suscetíveis.
Após a erradicação da doença, não houve mais necessidade de vacinar a população. Com isso as campanhas de vacinação contra varíola estão suspensas desde a década de 80. No Brasil, a campanha de vacinação se encerrou em 1979. Deve-se lembrar de que, em todas as pessoas vacinadas, a memória imunológica desaparece após vários anos, ou seja, quem estava vacinado naquela época, hoje está tão vulnerável quanto as pessoas que nunca foram vacinadas.
Apesar de erradicada, ainda há preocupações com o uso do vírus da Varíola como arma para o bioterrorismo. Uma vez que as pessoas nascidas depois de 1990 não estão imunizadas, permanecendo suscetíveis à ação do vírus.
Atualmente não há remédio contra a Varíola, sendo a vacinação a única maneira de promover uma prevenção eficaz. Uma promissora notícia é que no último ano foi aprovado o primeiro teste para um medicamento, mas esse não pode ser testado em um caso humano de varíola, o que deixa indefinida a sua situação numa emergência real.
A vacinação é o processo de preparo do sistema imune contra um patógeno específico. A vacina contra as doenças virais, como a varíola, contém ou um vírus inativado (um vírus incapaz de infectar o hospedeiro) ou um vírus atenuado (um vírus “enfraquecido” ou semelhante ao original, que gera uma infecção leve ou moderada). Este vírus inativado estimula a produção, no corpo humano, de anticorpos contra o vírus e de células ditas citotóxicas, que matam por contato direto as células infectadas pelo vírus no corpo do hospedeiro - são duas classes distintas de agentes do nosso próprio sistema de proteção contra um agente infeccioso específico, preparando o organismo para responder de forma eficiente contra o patógeno.
Para o caso de doenças contagiosas, a vacina é fundamental para criar uma proteção coletiva. Pessoas que não podem ser vacinadas, como indivíduos imunodeficientes, são protegidas do contágio pela barreira representada pelo conjunto de pessoas próximas (contatos) regularmente vacinadas, e, portanto, incapazes elas mesmas de transmitir a doença.
Esta é uma questão que vem sendo discutida pela Organização Mundial da Saúde ao longo de vários anos. Esse é um falso dilema. O vírus, nas condições em que é armazenado, não representa um perigo para a comunidade, pois muitas barreiras eficazes impedem o seu escape acidental. Por outro lado, é ilusória a ideia de que, ao destruir o último frasco contendo o vírus da varíola, o perigo representado por ele deixa de existir para sempre. Isso porque a estrutura do vírus é conhecida inclusive nas sequências do seu material genético que permitem recriar partículas virais infecciosas (tão letais quanto às isoladas da natureza) a partir da inoculação do material genético do vírus numa célula hospedeira, mesmo que este material genético seja sintetizado em laboratório a partir das sequências registradas em bancos de dados, em vez de ser isolado de um vírus encontrado em algum paciente.
Portanto, destruir o vírus não acaba com o risco. Não destruir o vírus pode, paradoxalmente, permitir estudá-lo mais adiante, se necessário, para desenvolver novos tratamentos (antivirais) e para procurar outras formas de vacinação mais eficazes.
Os locais onde estão armazenadas estas amostras possuem segurança máxima para amostras biológicas e o controle de acesso para pessoas autorizadas. Porém, caso ocorra uma exposição viral no ambiente, teoricamente este poderia contaminar a população não vacinada e se espalhar pelas cidades e países ao redor do acidente, causando doenças e mortes em grandes proporções.
No entanto, existem medidas que poderão ser seguidos para evitar a disseminação global da doença. Inicialmente, conter todos os pacientes infectados com o vírus, colocando-os em estado de quarentena, e ao mesmo tempo, vacinar a população das cidades ao redor do acidente, evitando que o vírus se espalhe.
A quarentena consiste em isolar os doentes em um ambiente separado de contato com a população em geral, não sendo esse isolamento prejudicial a eles, mesmo que sejam numerosos a ficar em quarentena no mesmo local, pois o contato com outros atingidos pela mesma infecção não é um fator agravante para o quadro deles. Essa providência evita que novas pessoas sejam infectadas. Para auxiliar no controle, os familiares dos doentes podem utilizar água fervente nas roupas usadas pelos infectados e evitar o contato direto com objetos que possam estar contaminados.
Já a vacinação em um curto espaço de tempo seria possível porque há, segundo a Organização Mundial de Saúde, meio milhão de vacinas contra a varíola ainda presentes no planeta. Se necessário, é possível produzir novos estoques de vacina para proteção em escala mundial porque o vírus vaccinia – a vacina originalmente usada para a erradicação da varíola - é facilmente obtido. O vírus vaccinia é utilizado em muitas aplicações científicas, graças ao seu poder imunizante (imunogenicidade), sua robustez (resistência à inativação no meio ambiente) e pela sua capacidade de receber novos genes por meio de técnicas de engenharia genética, o que possibilita o seu uso para vacinar contra outras doenças além da varíola.
Portanto, apesar dos riscos de ocorrer acidentes capazes de causar a liberação de um vírus ou um patógeno perigoso para a população, existem ferramentas e protocolos capazes de solucionar o problema de forma a causar o menor dano possível. Esclarecer essas questões é de grande utilidade para preparar o público no caso de emergências epidemiológicas, e para evitar a disseminação de falsas informações, que levam ao pânico.
Simonsen KA,Snowden J.Smallpox (Variola). StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020.
Meyer H, Ehmann R, Smith GL. Smallpox in the Post-Eradication Era.Viruses. 24;12(2), 2020.
Thèves C, Biagini P, Crubézy E. The rediscovery of smallpox. Clin Microbiol Infect. 20(3):210-8, 2014.
 Por Marcelo Lessa Jr. Aluno do curso de graduação em Ciências Biológicas Microbiologia e imunologia, 1o período. Matéria escrita na disciplina de extensão de integração acadêmica do Curso de Bacharelado em Ciências Biológicas: Divulgação Científica: para entender melhor o mundo. Creditação da extensão no Instituto de Microbiologia.
Por Marcelo Lessa Jr. Aluno do curso de graduação em Ciências Biológicas Microbiologia e imunologia, 1o período. Matéria escrita na disciplina de extensão de integração acadêmica do Curso de Bacharelado em Ciências Biológicas: Divulgação Científica: para entender melhor o mundo. Creditação da extensão no Instituto de Microbiologia.Já ouviu falar da CRISPR-Cas9? Independentemente da sua resposta, que tal falar um pouco dessa técnica tão impressionante quanto instigante?
Dentro de nossas células temos nosso material genético, nele estão contidas informações que têm grande peso em fazer com que você seja você. Esses dados ficam armazenados ou “escritos” na forma de DNA. E há diversos motivos para se querer alterar essas estruturas em animais, plantas ou até em humanos, como inativar um gene que cause uma doença. Agora vamos falar um pouco da CRISPR, ok? Seu nome vem da frase “clusteredregularlyinterspaced short palindromicrepeats”, ou em português, repetições palindrômicas curtas agrupadas e regularmente espaçadas. O lócus CRISPR é uma área do material genético de bactérias e arqueas onde se encontram essas repetições, que são “intercaladas” com pequenos pedaços de DNA de vírus que infectaram esses organismos no passado, ou seus antepassados, já que essa galeria de DNA viral é herdadapelos descendentes. Esse processo é parte de um mecanismo de defesa das bactérias e arqueas contra esses invasores. Quando um vírus, com uma sequência de DNA que já está contida nesse “histórico de ameaça” da bactéria ou arquea invade essa célula, ela envia uma enzima capaz de cortar a fita dupla do DNA viral na região em que há essa compatibilidade, uma dessas proteínas é a Cas9.Para essa enzima conseguir identificar essa parte do material genético do vírus que já é reconhecida como perigosa, a célula produz um complexo guia, contendo um RNA feito a partir da sequência de DNA viral que ela guarda. Desse jeito, os nucleotídeos que compõem esse RNA são complementares a área alvo do vírus.
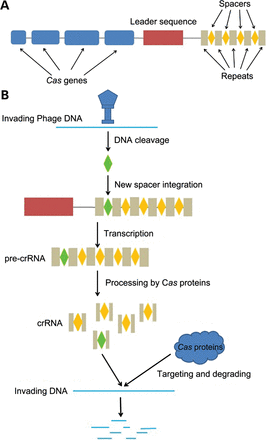
Figura 1:
A) Representação do lócus CRISPR.
B) “Coleta” de novo DNA viral e processo de quebra de DNA invasor.
Hum Mol Genet, Volume 23, Issue R1, 15 September 2014, Pages R40–R46, https://doi.org/10.1093/hmg/ddu125
Todo esse sistema de defesa pôde ser modificado para se tornar uma ferramenta de edição do genoma, totalidade dos genes. Em vez de cortar o DNA viral invasor, a Cas9 é “carregada” com um RNA guia que irá indicar que parte do DNA de um ser vivo deve ser cortada. Depois que ocorre esse dano na fita dupla de DNA, a célula começa um processo de reparo, que geralmente leva a retirada ou adição de nucleotídeos, descaracterizando a informação contida na antiga sequência, inutilizando o gene. Esse primeiro processo pode ser visado para “destruir” genes causadores de doenças, como a hemofilia, que é hereditária. Ou pode ajudar a identificar a função de determinado gene, analisando a diferença entre organismos com o gene ativo, e outros com o gene silenciado pelo processo. Em um segundo tipo de restauração, um novo pedaço de DNA, que traz novas informações, pode ser incorporado para ligar as duas pontas que foram desconectadas. Possibilitando inserir características de interesse nos organismos, como tornar espécies agrícolas mais resistentes a condições climáticas ou mais produtivas. E esses são só alguns exemplos de todo o potencial que essa nova tecnologia apresenta.
Vale mencionar que junto com todo esse potencial, vem uma extensa discussão de como e para que essa tecnologia deva ser utilizada. Justificada por fatores como o corte de áreas não intencionais do DNA pela Cas9, ou o uso dessa tecnologia para procedimentos sem o objetivo de tratar uma doença ou desordem, não terapêuticos, como usos estéticos, ou para a mudança da cor dos olhos, por exemplo. Ou até mesmo para a criação de “humanos melhorados” com genes que lhes atribuam benefícios, como resistência a doenças.
https://www.sciencenewsforstudents.org/article/explainer-how-crispr-works;
https://profissaobiotec.com.br/sistema-crispr-cas-da-bacteria-a-terapia-genica/;
https://www.youtube.com/watch?v=TdBAHexVYzc;
https://academic.oup.com/hmg/article/23/R1/R40/2900693.
