



 Por Marco Antônio Lemos Miguel
Por Marco Antônio Lemos Miguel
Atualmente o consumidor está mais atento à relação entre dieta e saúde, e busca produtos alimentícios com propriedades funcionais. Neste contexto, estão os alimentos probióticos, que são aqueles que contêm microrganismos vivos que, quando administrados em quantidades adequadas, conferem benefícios à saúde do hospedeiro. Entretanto, os produtos probióticos lácteos dominam o mercado, principalmente iogurtes e leites fermentados, que não atendem a toda a população em virtude da restrição a lacticínios por muitos indivíduos. Estima-se que a intolerância à lactose acometa 75% da população mundial e 25% dos brasileiros, enquanto a alergia ao leite ocorre em 1,9 a 7,5% da população brasileira, principalmente em crianças. Assim, uma alternativa é o desenvolvimento de produtos probióticos não lácteos.
Por outro lado, as mudanças nos hábitos culturais e alimentares têm difundido a culinária oriental, caracterizada por peixes e derivados crus altamente manipulados, que representa um risco de transmissão de doenças como gastroenterites. Desta forma, o trabalho de tese de Doutorado de Renata Rangel Guimarães, orientada pelo Prof. Marco Antônio Lemos Miguel, do Laboratório de Microbiologia de Alimentos do Instituto de Microbiologia da UFRJ desenvolveu uma “ova de peixe” probiótica (Figura 1), semelhante à de salmão, amplamente utilizada na culinária oriental. Esta “ova” é composta por um polissacarídeo e contêm em seu interior bactérias probióticas como Lactobacillus rhamnosus GG ou Bifidobacterium animalis, que podem oferecer benefícios à saúde de quem as consome.
Os pesquisadores acreditam que as ovas desenvolvidas possam ser consumidas juntamente com as ovas naturais nos pratos preparados, ajudando a proteger o consumidor de doenças como a gastroenterite, que pode ser originada tanto da refeição que ele está fazendo no momento quanto de outras. Outros benefícios podem ser obtidos como a prevenção ou melhora da constipação intestinal e produção de vitaminas pelas bactérias probióticas. Além disto, representa uma oportunidade de consumo de microrganismos probióticos por pessoas com intolerância à lactose e alergia às proteínas do leite.
O produto foi submetido a um teste sensorial com consumidores, tendo aceitação de 82%, e mais de 60% dos provadores afirmaram que certamente o comprariam.
A pesquisa entra agora em fase de adequação para uma possível produção industrial e comercialização.
 Por Marinella Silva Laport, 21 de agosto de 2012
Por Marinella Silva Laport, 21 de agosto de 2012
Elevados níveis de resistência bacteriana têm sido relatados em todo o mundo e a procura por novos antibióticos de diversas fontes se faz necessária. Entre essas fontes estão os organismos marinhos, principalmente as esponjas, que apresentam uma grande diversidade de metabólitos secundários com atividades farmacológicas. O nosso grupo tem investigado esponjas marinhas com atividade antibacteriana sobre bactérias resistentes. Dez espécies de esponjas coletadas no litoral da cidade do Rio de Janeiro apresentaram atividade antibacteriana, sendo que o extrato aquoso da esponja Petromica citrina foi o que apresentou o maior espectro de ação. Assim, foi realizada uma caracterização química e biológica da substância bioativa de P. citrina e o seu modo de ação foi investigado em células de Staphylococcus aureus.
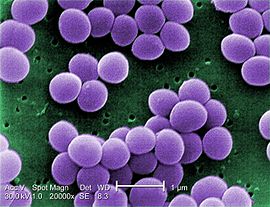 A atividade antibiótica do extrato aquoso foi determinada contra cerca de 60 estirpes tipo e clínicas resistentes a antibióticos. O extrato aquoso foi fracionado e a substância bioativa identificada por RMN e espectro de massa. O extrato aquoso foi ativo sobre a maioria das bactérias testadas, incluindo estirpes resistentes a antibióticos, como Enterococcus faecalis, S. aureus (MRSA), S. epidermidis, Mycobacterium abscessus subsp. bolletiie Neisseria gonorrhoeae.O extrato aquoso foi fracionado e o trisulfato de halistanol (isolado pela primeira vez a partir de P. citrina) foi identificado como sendo a principal substância bioativa. O trisulfato de halistanol tem um efeito bactericida sobre as células de S. aureus (CMI = 512 mg/L). Aparentemente, essa substância age sobre a membrana citoplasmática de S. aureus causando a lise celular. Esse antibiótico também apresentou toxicidade moderada contra as células eucarióticas L929 (fibrossarcoma). Esse trabalho demonstra que a esponja P. citrina tem um grande potencial antibacteriano, sendo uma fonte de substâncias e até para um protótipo de medicamento, para o tratamento de infecções causadas por bactérias resistentes.
A atividade antibiótica do extrato aquoso foi determinada contra cerca de 60 estirpes tipo e clínicas resistentes a antibióticos. O extrato aquoso foi fracionado e a substância bioativa identificada por RMN e espectro de massa. O extrato aquoso foi ativo sobre a maioria das bactérias testadas, incluindo estirpes resistentes a antibióticos, como Enterococcus faecalis, S. aureus (MRSA), S. epidermidis, Mycobacterium abscessus subsp. bolletiie Neisseria gonorrhoeae.O extrato aquoso foi fracionado e o trisulfato de halistanol (isolado pela primeira vez a partir de P. citrina) foi identificado como sendo a principal substância bioativa. O trisulfato de halistanol tem um efeito bactericida sobre as células de S. aureus (CMI = 512 mg/L). Aparentemente, essa substância age sobre a membrana citoplasmática de S. aureus causando a lise celular. Esse antibiótico também apresentou toxicidade moderada contra as células eucarióticas L929 (fibrossarcoma). Esse trabalho demonstra que a esponja P. citrina tem um grande potencial antibacteriano, sendo uma fonte de substâncias e até para um protótipo de medicamento, para o tratamento de infecções causadas por bactérias resistentes.
Referência:
Marinho PR, Simas NK, Kuster RM, Duarte RS, Fracalanzza SE, Ferreira DF, Romanos MT, Muricy G, Giambiagi-Demarval M, Laport MS. Antibacterial activity and cytotoxicity analysis of halistanol trisulphate from marine sponge Petromica citrina. J Antimicrob Chemother. 2012 In press.
 Laboratório de biologia de anaeróbios
Laboratório de biologia de anaeróbios
Por Leandro A. Lobo e Regina M.C.P. Domingues
A maneira como micro-organismos e seus hospedeiros se associam pode oscilar radicalmente, desde uma interação benéfica de mutualismo, em que a interação entre esses dois organismos pode ser tão íntima a ponto de um não viver sem o outro, até o parasitismo, em que um micro-organismo se beneficia em detrimento do organismo hospedeiro. Em um artigo publicado na revista Science em julho de 2012, Somvanchi e colaboradores analisaram a fundo a interação de simbiose entre a bactériaPhotorhabdus luminescens e o nematóide Heterorhabditis bacteriophora, que juntos infectam, matam e se reproduzem em insetos hospedeiros. A bactéria na sua forma mutualistica (forma M) é verticalmente transmitida para as formas juvenis do nematóide em desenvolvimento dentro do nematóide adulto e as coloniza graças à expressão de uma proteína filamentosa de superfície, a fimbria Mad (maternal adhesion). Quando as formas jovens infecciosas (JI) do nematóide colonizam o inseto hospedeiro, essas bactérias são regurgitadas e se multiplicam produzindo toxinas inseticidas. O cadáver do inseto passa a ser utilizado pelo nematóide como fonte de nutrientes e abrigo. No inseto, essas bactérias também produzem proteínas (CipA e CipB) ricas em aminoácidos essenciais indispensáveis para o crescimento do nematóide e antimicrobianos que evitam que microrganismos concorrentes se multipliquem na carcaça do inseto. Nesse estágio, as bactérias se encontram na sua forma patogênica (forma P). Surpreendentemente, as diferenças entre as formas M e P da bactéria se devem a uma simples inversão do promotor bacteriano que controla a expressão do locus Mad. Esse controle do tipo liga/desliga é mediado por uma invertase bacteriana chamada MadO e ocorre de forma estocástica. Nesse artigo, os autores manipulam geneticamente uma cepa dePhotorhabdus luminescens de forma que esta permaneça “travada” na forma M ou P. Análises fenotípicas demonstraram que a bactéria na forma mutualista (M) possui menores dimensões, crescimento mais lento, capacidade limitada de produção de diversas antimicrobianos, enzimas e proteínas importantes na infecção do inseto e consequentemente uma virulência reduzida em um modelo de infecção em larvas de Galleria mellonella (uma espécie de mariposa). Apesar de prevalente no nematóide adulto e da óbvia vantagem adaptativa das formas P, as formas M são preferencialmente transmitidas à prole graças à expressão da adesina Mad. À medida que o nematóide amadurece, as formas P prevalecem. Quando alcança a forma juvenil infecciosa, já esta “armada” para o combate com o inseto hospedeiro.
É interessante notar que bactérias da espécie Bacteroides fragilis, que fazem parte da microbiota intestinal humana controlam a expressão de um dos seus mais importantes fatores de virulência, a cápsula polissacarídica, de forma similar. Estruturalmente, esses polissacarídeos compõem um complexo iônico de moléculas referido como Complexo Polissacarídico Capsular (CPC) que é capaz de induzir a formação de abscessos intra-abdominais em animais de experimentação. Em 2001, Krinos e colaboradores demonstraram que a espécie é capaz de modular seus antígenos de superfície pela expressão de até oito polissacarídeos capsulares distintos (PSA-PSH) através de um mecanismo do tipo “liga – desliga” de promotores contendo inversões reversíveis de segmentos de DNA. Isto quer dizer que a espécie é capaz de exibir uma ampla combinação de polissacarídeos de superfície, o que pode ter grande implicação na sua manutenção no hospedeiro, seja em sítios infecciosos ou em populações de microbiota. Apesar do inquestionável papel do CPC na patogênese das infecções causadas por B. fragilis, recentemente foi verificado que o polissacarídeo A (PSA) ajuda a proteger o hospedeiro de doenças inflamatórias intestinais (MAZMANIAN, ROUND & KASPER, 2008).
O artigo de Somvanshi e colaboradores descreve, de forma elegante, como um processo aleatório e extremamente simples de regulação gênica pode promover mudanças marcantes na fisiologia celular de Photorhabdus luminescens e na sua interação de parasitismo/cooperação em diferentes hospedeiros. Mas não devemos esquecer que nós mesmos vivemos uma íntima e dinâmica associação com milhares de espécies bacterianas da nossa microbiota que possuem mecanismos de regulação gênica extramente semelhantes ao descrito em P. luminescens. De forma similar, o balanço entre agressão e cooperação na nossa microbiota está em constante mudança, evidenciando a importância e fragilidade desse tipo de interação.
Referências:
SOMVANSHI VS, SLOUP RE, CRAWFORD JM, MARTIN AR, HEIDT AJ, KIM KS, CLARDY J, CICHE TA. A single promoter inversion switches Photorhabdus between pathogenic and mutualistic states.Science. 2012 Jul 6;337(6090):88-93
KRINOS, C.M.; COYNE, M.J.; WEINACHT, K.G.; TZIANABOS, A.O.; KASPER, D.L. & COMSTOCK, L.E. Extensive surface diversity of a commensal microorganism by multiple DNA invertions. Nature, 414, 555-558, 2001.
MAZMANIAN, S.K.; ROUND, J.L. & KASPER, D.L. A microbial symbiosis factor prevents intestinal inflammatory disease. Nature, 453, 620-625, 2008.
