



 Por Deborah Leite
Por Deborah Leite
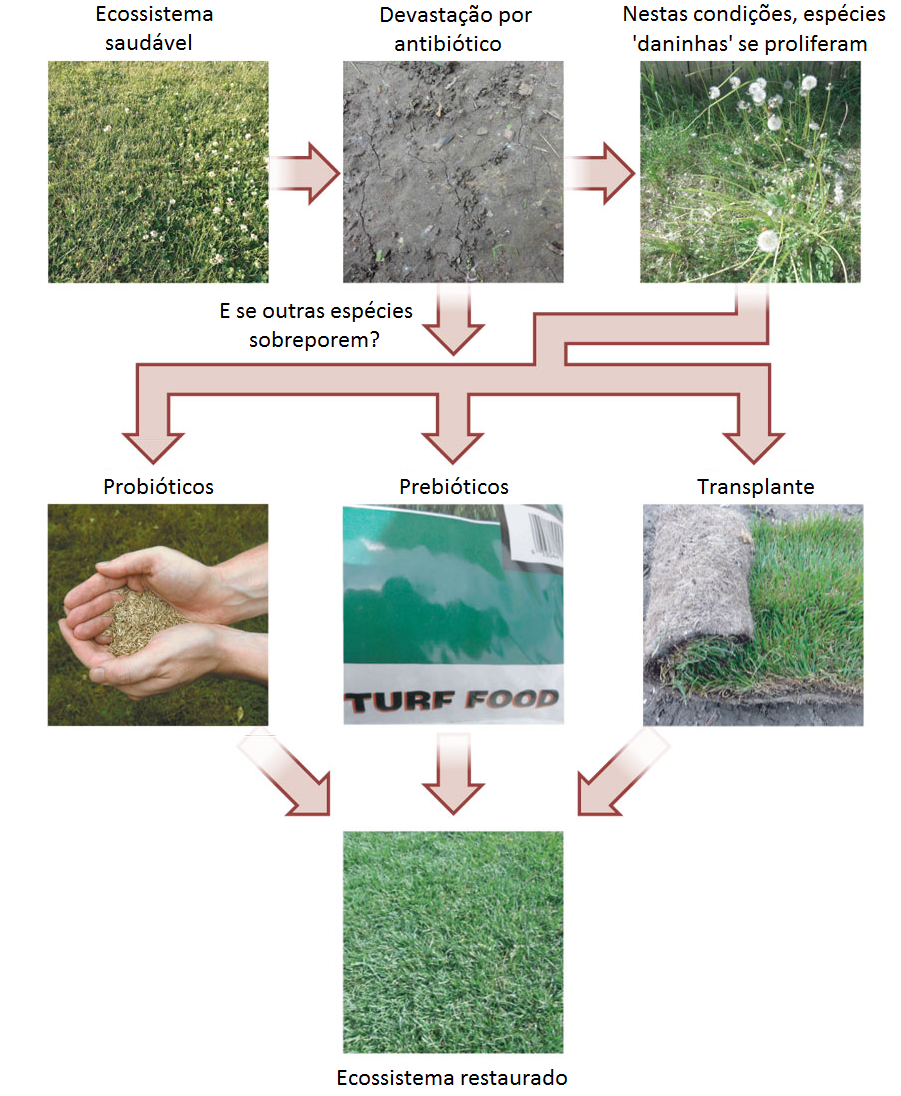
A microbiota intestinal humana exerce um papel importante tanto na saúde quanto na doença. E em alguns aspectos, a manutenção de uma microbiota saudável se assemelha a cuidar de um jardim (Figura 1). Por vezes, intervenções graves podem levar à degradação total deste ecossistema, como por exemplo, através de doenças e/ou pelo uso de antibióticos. Embora seja possível a recuperação espontânea, não é garantido que ela ocorra em todos os casos. Devido a isto, várias estratégias podem ser utilizadas para restaurar este ecossistema: probióticos, prebióticos ou até mesmo transplantar o ecossistema microbiano inteiro, por exemplo, a partir de uma amostra de fezes e um processo denominado transplante fecal.
Estas estratégias podem estar associadas a suplementação da dieta com carboidratos não-digeríveis (prebióticos) que são benéficos, porque estimulam seletivamente o crescimento e a atividade de uma ou mais espécies bacterianas no cólon. Outra forma de recuperação ou fortalecimento deste ecossistema intestinal seria através da ingestão de micro-organismos vivos, administrados em quantidades adequadas e que conferem benefícios à saúde do hospedeiro (probióticos). Os probióticos em sua maioira pertencem aos gêneros Lactobacillus, Bifidobacterium e Bacillus. Entretanto em alguns caso graves de diarréia crônica é necessário lançar mão de uma medida capaz de restaurar a complexa microbiota intestinal por completo e neste caso transplante fecal é uma opção terapêutica.
A maioria das pessoas já ouviu falar sobre probióticos e prebióticos, mas poucos conhecem algo sobre transplante fecal. Apesar de poucas pessoas conhecerem esta técnica, o transplante fecal não é uma prática nova. O primeiro caso foi descrito por Eiseman e colaboradores em 1958, e a descrição do segundo ocorreu em 1981 por Bowden. Hoje este tipo de terapia é utilizada por vários especialistas com sucesso, sem quaisquer efeitos adversos. Desde então, existem muitos relatos de transplantes de fezes através de colonoscopia ou sonda nasogástrica, e a maioria destes procedimentos estavam relacionados a utilização desta técnica no tratamento da infecção por Clostridium difficile, para o restabelecimento da microbiota após a infecção. Um dos principios do método do transplante fecal é que nem todos os micro-organismos da microbiota podem ser isolados e cultivados em laboratório.
Recentemente, 19 pacientes infectados por C. difficile foram submetidos a um transplante de fezes (Figura 2) e permaneceram livres da doença por até quatro anos. Este resultado sugere que esta terapia pode ser benéfica para o tratamento desta doença, e segundo outros trabalhos é eficaz no tratamento de outros tipos de gastroenterites. Já existem estudos que relatam que o uso progressivo de antibióticos contra C. difficile e outros micro-organismos também é capaz de afetar negativamente a microbiota e sugerem que a recolonização do trato intestinal por uma nova microbiota pode ser empregada através do transplante.
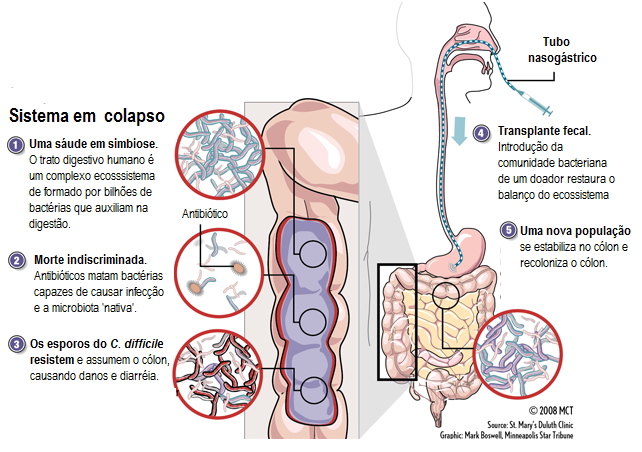
Em outro estudo sobre o tema, foram utilizadas técnicas moleculares a fim de reconhecer os grupos microbianos bioindicadores de uma microbiota ‘saudável’ ou ‘doente’. Este estudo descreve o efeito de uma bacterioterapia através de um transplante fecal em pacientes com diarréia a fim de restabelecer a microbiota do cólon. Neste estudo, Firmicutes e Bacteriodetes não foram encontrados nos indivíduos doentes e dias após o transplante já foi possível ver reestabelecimento da microbiota e a recuperação do quadro clínico.
Vale a pena lembrar que o entendimento sobre o efeito da aplicação desta técnica parte de princípios ecológicos como interações entre hospedeiro e micro-organismos. Portanto, estudos sobre a composição, a diversidade e a função de comunidades microbianas intestinais são importantes para elaborar estratégias para tratamentos futuros.
O Transplante fecal, embora pareça ser uma abordagem estranha para os leigos, pode ser uma boa opção de tratamento e tem a capacidade de restabelecer a microbiota intestinal saudável. Por mais desagradável que possa parecer.
Referências:
Eisman, B.; Silen, W; Bascom, G.S.; Kauvar, A.J. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery. 1958;44(5):854-859.
Bowden, T.A.; Mansberger, A.R.; Lykins, L.E. Pseudomembranous enterocolitis: mechanism of restoring floral homeostasis. Am Surg. 1981;47:178-183.
Yoon, S.; Brandt, L.J. Treatment of refractory/recurrent C. difficile-associated disease (CDAD) by donated stool transplanted via colonoscopy: a case series of twelve patients. Journal of Clinical Gastroenterology. 2010;44:562-566
Grehan, M.J.; Borody, T.J.; Leis, S.M.; Campbell, J.; Mitchell, H.; Wettstein, A. Durable alteration of the colonic microbiota by the administration of donor fecal flora. Journal of Clinical Gastroenterology. 2010; 44(8):551-561.
Floch, M. H. Fecal Bacteriotherapy, Fecal Transplant, and the Microbiome. Journal of Clinical Gastroenterology. 2010; 44(8): 529-530
Khoruts, A.; Dicksved, J.; Jansson, J.K.; Sadowsky, M. J. 2010. Changes in the composition of the human fecal microbiome following bacteriotherapy for recurrent Clostridium difficile-associated diarrhea. Journal of Clinical Gastroenterology. 2010, 44:354-360.
Lozupone, C.A.; Stombaugh, J.; Jansson, J.K.; Gordon, J.I.; Knight, R. Factors that shape composition and resilience of human intestinal microbiota. Nature. 2012. (in press)
 Por Lígia Guedes da Silva
Por Lígia Guedes da Silva
Pneumococos são as principais bactérias associadas ao desenvolvimento de pneumonia e meningite na população – principalmente entre crianças e pessoas imunocomprometidas. As doenças graves causadas por esse micro-organismo podem ser fatais, mesmo quando antibióticos são usados. A eficiência do tratamento depende da ação conjunta do sistema imune do paciente e da ação direta do antibiótico sobre a bactéria, e a seleção e espalhamento de bactérias resistentes limita as opções de tratamento e dificulta aos médicos a escolha da melhor concentração e de qual antibiótico a empregar.
O sistema complemento é uma das maneiras de nosso sistema imune reagir a infecções, e ele envolve uma série de proteínas que podem se ligar às bactérias facilitando sua eliminação. Ele é um dos mecanismos da nossa chamada defesa inata, que é que uma das primeiras linhas de defesa do nosso corpo. Já foi observado que pessoas que possuam defeitos nesse sistema de defesa têm mais chances de desenvolver doenças graves por várias bactérias em que esse sistema é importante para a eliminação – e os pneumococos se incluem nesse caso.
Com o espalhamento da resistência a diversos antibióticos, estratégias diferenciadas de tratamento podem ser a solução para driblar esse problema. Não por acaso, um grupo de cientistas espanhóis recentemente publicou um artigo onde defendem a ideia de que concentrações sub-inibitórias (ou seja, menores que as necessárias para completa eliminação das bactérias) de antibióticos específicos possam contribuir para a maior eficiência do sistema complemento, e assim, ajudar a eliminar essas bactérias, mesmo as que apresentem resistência a esses mesmos antibióticos.
Ao misturarem soro sanguíneo de pessoas vacinadas que já haviam desenvolvido anticorpos anti-pneumococos e concentrações sub-inibitórias de antibióticos às bactérias, os cientistas observaram um aumento na ligação das proteínas do sistema complemento aos pneumococos – o que não acontecia quando apenas o soro e as bactérias eram misturados. Essa ligação das proteínas às bactérias retardou o desenvolvimento de doença, além de possibilitar a eliminação delas e diminuir as taxas de mortalidade em modelo animal, conforme observado em um outro estudo.
A ação dos antibióticos pode levar a alterações na superfície bacteriana, podendo assim expor antígenos da bactéria que são pouco expressos ou que em geral estão mais escondidos. Os cientistas acreditam que é essa exposição que pode auxiliar no processo de reconhecimento da bactéria pelo sistema imune, o que por sua vez auxiliaria na sua eliminação.
Tal estratégia parece também se aplicar a antifúngicos no tratamento de micoses, em que novamente, concentrações sub-inibitórias foram capazes de estimular os mecanismos de defesa contra o fungo Aspergillus fumigatus.
O emprego desse tipo de estratégia pode diminuir as chances de falha de tratamento em pessoas que já foram vacinadas contra pneumococos, e que porventura estejam infectadas por estirpes resistentes a antibióticos. É provável que essa estratégia também possa ser aplicada para o tratamento de doenças causadas por outros micro-organismos, e apenas mais estudos podem responder a essa questão.
Referências Bibliográficas:
Ramos-Sevillano E, Rodríguez-Sosa C. Cafini F, Giménez MJ, Navarro A, Sevillano D, Alou L, García E, Aguilar L & Yuste J. (2012) Cefditoren and ceftriaxone enhance complement-mediated immunity in the presence of specific antibodies against antibiotic-resistant pneumococcal strains. PLoS One. 2012; 7(9): e44135.
Cafini F, Yuste J, Gime´nez MJ, Sevillano D, Aguilar L, et al. (2010) Enhanced in vivo activity of cefditoren in pre-immunized mice against penicillin-resistant S. pneumoniae (serotypes 6B, 19F and 23F) in a sepsis model. PLoS One 5: e12041.
Gaziano R, Bozza S, Bellocchio S, Perruccio K, Montagnoli C, et al. (2004) Anti-Aspergillus fumigatus efficacy of pentraxin 3 alone and in combination with antifungals. Antimicrob Agents Chemother 48: 4414–4421.
 Por Dayanne da Rocha de Menezes
Por Dayanne da Rocha de Menezes
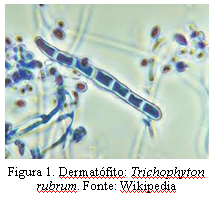
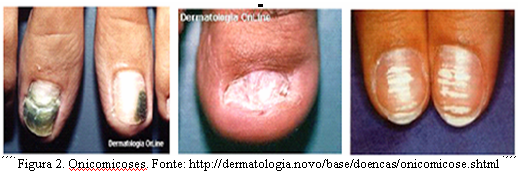
A onicomicose conhecida, popularmente, como micose de unha, é a doença mais comum das unhas e é causada, em sua maioria, por fungos dermatófitos e espécies da levedura Candida sp. Em ambientes úmidos e quentes, os fungos se reproduzem rapidamente e podem dar origem a um processo infeccioso. A gravidade e a suscetibilidade para contrair estas infecções dependem de fatores que incluem o histórico familiar da doença, trauma prévio e a condição geral de saúde e imunológica. A micose de unha é uma doença de incidência considerável, acometendo cera de 20% da população acima dos 40 anos, sendo especialmente maior entre mulheres devido a fatores de risco como freqüentar salões de beleza e maior exposição dos pés pelo uso de calçados abertos. Cerca de 50% das pessoas com idade superior a 60 anos sofrem desse mal, devido a queda da imunidade devido a doenças e ingestão de medicamentos que debilitam o organismo. As manifestações mais comuns da onicomicose são o deslocamento da borda livre, provocando acúmulo de material debaixo da unha, deformação da unha que ficam frágeis e quebradiças, crescimento irregular tornado-se ondulada, aumento da espessura da unha e endurecimento e manchas brancas na superfície (figura 2)
Uma pessoa pode contrair uma onicomicose por diversas formas, podendo ser a partir do meio ambiente, de animais, outras pessoas, lixas de unha, alicates e tesouras contaminadas. O solo é uma poderosa fonte de micro-organismos e por esse motivo a onicomicose é comum em manipuladores de frutas e jardineiros.
O ambiente úmido, escuro e aquecido, encontrado dentro dos sapatos e tênis, também favorece o seu crescimento de fungos. Além disso, a queratina, proteína que forma as unhas, é fonte de alimento para este micro-organsimos. O tratamento das micoses de unha pode ser demorado e depende da eliminação da unha contaminada. São raros os casos de crianças acometidas pela onicomicose, talvez pelo rápido crescimento das unhas nesta idade. Sabendo um pouco mais sobre as possíveis causas e características das desagradáveis onicomicoses, quando suas unhas apresentarem alterações que desperte a suspeita de micose, procure um médico. Ele lhe indicará o tratamento adequado.
Referências e literatura recomendada:
Dermatologia.net. Doenças da pele. Disponível em: http://dermatologia.net/novo/base/doencas/onicomicose.shtml. Acessado em: 06/11/2012
Tchernev G, et all. Onychomycosis: modern diagnostic and treatment approaches. 2012 Sep 30.
Uci.farma. Onicomicose. Disponível em: http://www.uci-farma.com.br/saude_e_qualidade_de_vida/id:71. Acessado em: 19/11/2012
Vale N. Minhavida saúde, alimentação e bem estar. Disponível em: http://www.minhavida.com.br/saude/materias/10835-conheca-4-verdades-e-5-mitos-sobre-micoses-de-unhas. Acessado em: 06/11/2012
