



 Por Andréa Pestana
Por Andréa Pestana
Em nota do dia 23 de janeiro, Shell Brasil anunciou parceria com duas universidades brasileiras, UFRJ e USP para desenvolvimento de projeto com objetivo de estudar e entender melhor a vida e o ecossistema em águas profundas.
Na UFRJ a equipe do laboratório LEMM, coordenada pela professora Raquel Peixoto trabalhará em parceria com a equipe da USP na realização de expedições pela costa sudeste do Brasil.
Cabe a equipe da UFRJ, com o apoio da Universidade de New South Wales, de Sydney, na Austrália, mapear a diversidade de corais e esponjas e acompanhar suas adaptações ao ambiente de mar profundo, e como respondem às mudanças ambientais. Para tanto, será construído um sistema avançado de aquário, “Deep Sea Simulator”, que simulará e manipulará as condições encontradas no fundo do mar. Em um segundo momento, os pesquisadores desenvolverão probióticos com consórcios microbianos benéficos (BMC, na sigla em inglês), que permitirão que os corais lidem melhor com estressores ambientais, incluindo alterações climáticas.
Os pesquisadores contarão com uma embarcação dotada de equipamentos de alta tecnologia, dentre eles, um veículo de operação remota (ROV, na sigla em inglês).
A maior preocupação da empresa é garantir ao projeto uma dinâmica que respeite o meio ambiente e sua preservação, segundo Aly Brandenburg, gerente geral de tecnologias de subsuperfície da Shell Brasil.
“Tornar nossas operações mais seguras e garantir a preservação da vida marinha sempre foram questões fundamentais para a Shell Brasil. Agora, com esse projeto, poderemos ir além, ajudando toda a indústria na compreensão desse ecossistema tão específico e pouco acessível, garantindo que ele seja conservado”.
Os pesquisadores do Instituto Oceanográfico da USP irão procurar e monitorar sistematicamente as exsudações de petróleo e gás natural e as suas consequências para o ecossistema.
As novas informações reunidas no projeto e as inovações decorrentes dele contribuirão para melhor compreender as fronteiras biológicas da vida no fundo do mar e assegurar a sua preservação para as gerações futuras.
 A Revista Micro in Foco nº 34, da Sociedade Brasileira de Microbiologia, traz uma matéria sobre o grande problema que estamos atravessando do ressurgimento dos casos de sarampo, além de outros assuntos de grande interesse como o estudo da graduanda, Julianna Camille, sobre a confecção de um glossário sobre Microbiologia para a Linguagem Libras para surdos. Confira!
A Revista Micro in Foco nº 34, da Sociedade Brasileira de Microbiologia, traz uma matéria sobre o grande problema que estamos atravessando do ressurgimento dos casos de sarampo, além de outros assuntos de grande interesse como o estudo da graduanda, Julianna Camille, sobre a confecção de um glossário sobre Microbiologia para a Linguagem Libras para surdos. Confira!
Para acessar o pdf da Micro in Foco nº 34, clique aqui.
 Por Ana Paula Vieira Colombo, Professora Associada e Chefe do Departamento de Microbiologia Médica, Laboratório de Microbiologia Oral
Por Ana Paula Vieira Colombo, Professora Associada e Chefe do Departamento de Microbiologia Médica, Laboratório de Microbiologia Oral
Nos últimos 10 anos, desde o início do Projeto do Microbioma Humano, estudos científicos ao redor do mundo vem enfatizado o papel crucial que as diferentes microbiotas que colonizam nosso corpo tem na genética, fisiologia e biologia do organismo humano. E mais ainda, como essas microbiotas podem nos proteger de patógenos exógenos, mas também podem resultar em processos infecciosos. Essa relação de anfibiose entre nossa microbiota e nossas células é um conceito antigo, porém somente mais recentemente tem-se desvendado os mecanismos que direcionam essa microbiota ao desenvolvimento de uma relação benéfica ou antagônica conosco. A função do microbioma que coloniza nosso corpo vai muito além da proteção contra patógenos, desenvolvimento e amadurecimento do sistema imunológico, produção de vitaminas ou atuação no metabolismo de lipídeos e outros componentes provenientes da nossa dieta. Hoje já há evidências de que perfis específicos da microbiota intestinal e/ou oral estão associados a várias doenças inflamatórias, autoimunes e até mesmo doenças que afetam o sistema nervoso central. Os microrganismos que colonizam nosso organismo co-evoluíram e se adaptaram ao nosso corpo durante milhões de anos, e portanto, na maior parte do tempo, convivem em harmonia e equilíbrio conosco. Entretanto, fatores ambientais, comportamentais e genéticos podem levar a alterações ecológicas e, consequntemente, ao desequilíbrio de uma determinada microbiota (disbiose). Num microbioma disbiótico, pode-se observar uma alteração na composição e função da comunidade microbiana residente, normalmente associada ao supercrescimento de microrganismos com maior potencial patogênico. O microbioma oral, em particular, constitui um exemplo clássico de microbiota anfibiôntica. É um dos mais dinâmicos e divesificados microbiomas do organismo humano devido à grande variedade de nichos ecológicos e superfícies distintas de colonização presentes na cavidade bucal (figura 1). A disbiose do microbioma oral pode levar a doenças orais bastante prevalentes, como a cárie e as doenças periodontais (DPs). A DP é uma infecção polimicrobiana associada ao biofilme dental periodontopatogênico, de natureza multifatorial, que resulta em um processo inflamatório crônico dos tecidos de suporte e sustentação dos dentes de indivíduos susceptíveis, levando eventualmente à perda do elemento dentário (Figura 2). É uma das doenças inflamatórias crônicas humanas mais frequentes na população mundial. A DP pode apresentar manifestações clínicas distintas, e diferentes graus de acometimento, podendo se apresentar como uma gengivite localizada até uma periodontite avançada generalizada. Além do impacto das doenças periodontais na qualidade de vida e saude oral dos indivíduos, dados da literatura tem indicado as doenças e/ou patógenos periodontais como possíveis fatores de risco ao desenvolvimento ou agravamento de várias outras condições sistêmicas de natureza crônico-inflamatória. Entre essas, destacam-se as doenças cardiovasculares, diabetes, síndrome metabólica, obesidade, artrite reumatóide, cancer, doença renal crônica, doenças respiratórias e Alzheimer. Os principais mecanismos que suportam a associação entre essas doenças/condições incluem constante bacteremia de patógenos periodontais, dano metastático e inflamação metastática. Cerca de 4 anos atrás, nosso grupo de pesquisa propôs uma outra possível via que justificasse a forte associação entre essas doenças, através da rota cavidade bucal-mucosa intestinal. Nossa hipótese afirma que, em pacientes com doenças periodontais, a frequente ingestão de altas concentrações de patógenos periodontais durante longos períodos de tempo resulta na disbiose do microbiome intestinal, favorecendo o estabelecimento de um microbioma com "perfil inflamatório" comumente observado em condições inflamatórias sistêmicas. De fato, um grupo de pesquisadores japonêses reportou que a administração oral de Porphyromonas gingivalis, um patógeno periodontal clássico, em modelo animal leva ao aumento nos níveis de endotoxina sérica, resistência à insulina, esteatose hepática, enfim, sinais e sintomas de inflamação sistêmica. Porém, não há estudos clínicos testando essa possível rota de associação entre doenças periodontais e doenças sistêmicas inflamatórias. Em 2014, iniciamos um estudo clínico exploratório observacional como projeto de doutorado da aluna egressa do programa de pós-graduação em Ciências (Microbiologia), Talita Gomes Baêta Lourenço, no qual avaliamos a composição da microbiota oral e intestinal de pacientes com diferentes condições periodontais (saude, gengivite e periodontite crônica). Dados parciais publicados desse estudo demonstram que a diversidade da microbiota intestinal está reduzida em indivíduos com periodontite em relação àqueles saudáveis. Baixa diversidade na microibota intestinal tem sido relacionada a várias condições inflamatórias sistêmicas. Também observamos, através do sequenciamento de última geração do gene 16S rRNA bacteriano, uma alta prevalência e altos níveis de patógenos orais na microbiota intestinal desses pacientes. Alguns desses microrganismos orais apresentaram correlação significativa com sinais de inflamação e destruição periodontais. Logo, é possível que patógenos periodontais consigam resistir o sistema gastro-intestinal e atingir a microbiota intestinal de modo a causar uma disbiose caracterizada por uma redução na diversidade desse microbioma. Se esses patógenos orais colonizam ou não a mucosa intestinal, e quais mecanismos ocorrem nessas interações entre bactérias orais e intestinais necessitam ser investigados. Esse trabalho ainda está em andamento, e no momento estamos ampliando o tamanho da população do estudo, bem como otimizando a metodologia de processamento das amostras e sequenciamento. Além disso, estamos dando início a um estudo clínico randomizado e controlado com placebo no qual iremos analisar o impacto do tratamento periodontal básico com o uso adjunto de probióticos na composição da microbiota intestinal e na melhora clínica de pacientes com periodontite avançada. Nossa proposta é que a terapia periodontal auxilia na restauração do microbioma intestinal (aumento da diversidade microbiana), que consequentemente tem um efeito benéfico sobre parâmetros clínicos periodontais de saude.
Os resultados parciais da tese de doutorado da aluna Talita podem ser acessados aqui.
Arimatsu K, Yamada H, Miyazawa H, et al. Oralpathobiont induces systemic inflammation and metabolic changes associated with alteration of gut microbiota. Sci. Rep. 2014;4:4828.
Cho I, Blaser MJ. The human microbiome: at the interface of health and disease. Nat Rev Genet. 2012;13:260-270.
Darveau RP. Periodontitis: a polymicrobial disruption of host homeostasis. Nat. Rev. Microbiol. 2010;8(7):481-490.
Duvallet C, Gibbons SM, Gurry T, et al. Meta analysis of microbiome studies identifies disease-specific and shared responses. Nat Commun. 2017;8(1):1784.
Hajishengallis G, Liang S, Payne MA, et al. Low-abundance biofilm species orchestrates inflammatory periodontal disease through the commensal microbiota and complement. Cell Host Micro. 2011;10:497–450.
Han YW, Wang X. Mobile Microbiome: Oral Bacteria in Extra-oral Infections and Inflammation. J Dent Res. 2013; 92:485-491.
Jack G, Caton JG, ArmitageG, Berglundh T, Chapple ILC, Jepsen S, Kornman KS, Mealey BL, Panos N. Papapanou PN, Sanz M, Tonetti MS. A new classification scheme for periodontal and peri‐implant diseases and conditions – Introduction and key changes from the 1999 classification. J Clin Periodontol. 2018;45:45(Suppl 20);S1–S8. doi.org/10.1111/jcpe.12935
Koren O, Spor A , Felin J, et al. Human oral, gut, and plaque microbiota in patients with atherosclerosis. Proc Natl Acad Sci U S A.2011;108 (Suppl 1):4592-4598.
Nakajima M, Arimatsu K, Kato T, et al. Oral administration of P. gingivalis induces dysbiosis of gut microbiota and impaired barrier function leading to dissemination of enterobacteria to the liver. Plos One 2015;10: e0134234.
Wahaidi VY, Kowolik MJ, Eckert GJ, et al. Endotoxemia and the host systemic response during experimental gingivitis. J Clin Periodontol. 2011;38:412–417.
Winning L, Patterson CC, Cullen KM, et al. The association between subgingival periodontal pathogens and systemic inflammation. J Clin Periodontol. 2015;42:799–806.
Winning L, Linden GJ. Periodontitis and Systemic Disease: Association or Causality? Curr Oral Health Rep. 2017;4:1-7.
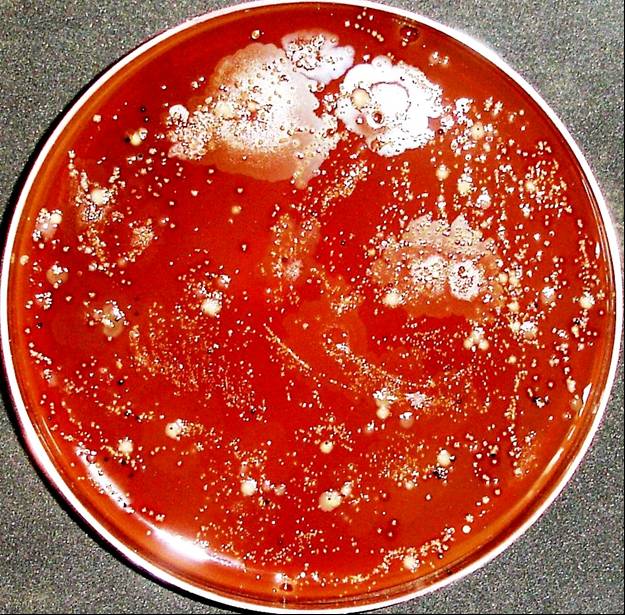
Figura 1. Cultivo em placa de ágar sangue e anaerobiose do biofilme subgengival coletado de bolsa periodontal de paciente com periodontite crônica. Fonte: Profa. Ana Paula Vieira Colombo.
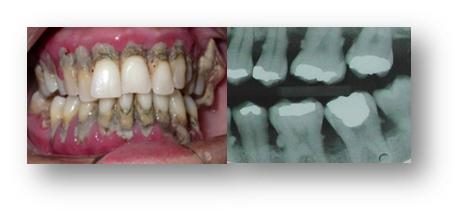
Figura 2. Aspectos clínico e radiográfico da Periodontite. Pode-se observar inflamação e destruição periodontal associadas a grandes quantidades de biofilme e cálculo dental, bem como perda óssea alveolar. Fonte: Profa. Ana Paula Vieira Colombo.
